はじめに
理科の実験や自由研究で結晶を作った経験がある人が多いのではないでしょうか。結晶にした原料は、食塩かミョウバンだったと思います、今回の記事では、それらとは違う結晶構造を持つロッシェル塩の結晶を作ってみようと思います。
0. 出発原料と目的生成物
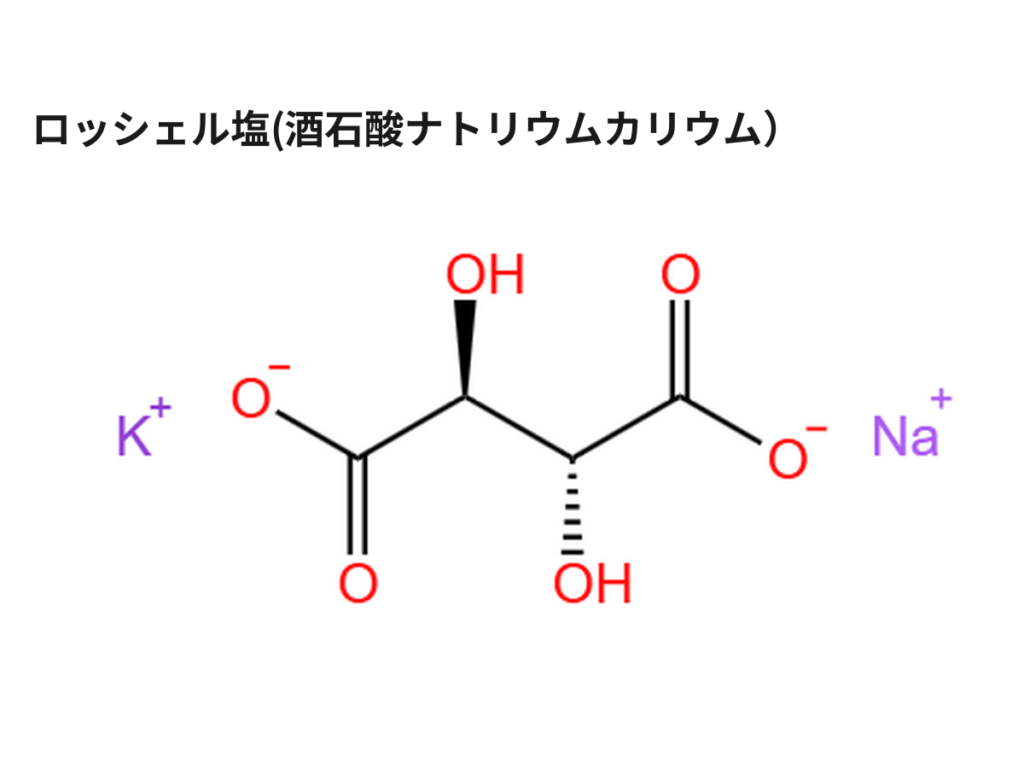
ロッシェル塩(酒石酸ナトリウムカリウム)はそのままだと、販売されていなかったり、高価であったりして入手性が悪いので、比較的安い原料で合成します。
原料と生成物:
| 物質名 | 化学式 | モル質量 | 備考 |
| 酒石酸水素カリウム | \(KHC_4H_4O_6\) | \(188.18 \, \text{g/mol}\) | 製菓用「クリームタータ」として流通 |
| 重曹 | \(NaHCO_3\) | \(84.01 \, \text{g/mol}\) | 炭酸水素ナトリウム。掃除・食品用 |
| ロッシェル塩 (目的物) | \(KNaC_4H_4O_6 \cdot 4H_2O\) | \(282.22 \, \text{g/mol}\) | 四水和物として析出 |
酒石酸と酒石酸水素カリウム
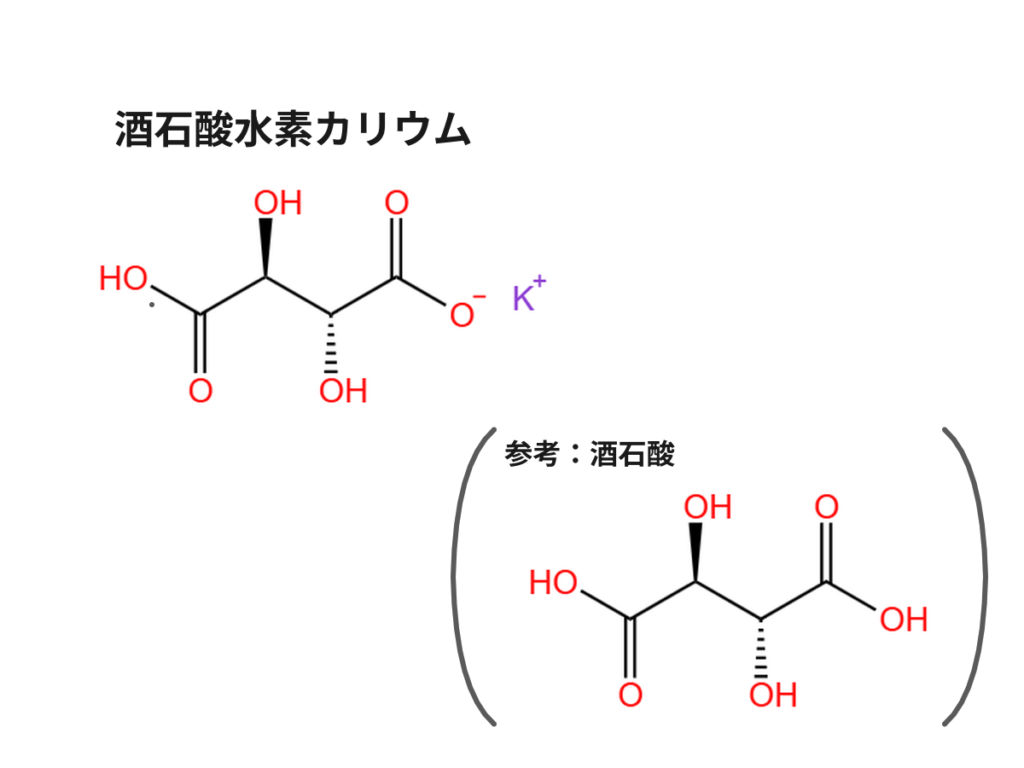
酒石酸ナトリウムカリウムは、酒石酸水素カリウムとほぼ同じで、もう片方の-OHからHが脱離してナトリウムイオンと対イオンに変わっただけの構造をしています。
酒石酸水素カリウム(入手元Amason)

酒石酸水素カリウム
今回の実験に使った酒石酸水素カリウムです
広告
1.前処理:重曹の熱分解反応
重曹を焼いておく
重曹をそのまま反応させると、大量の二酸化炭素が発生し、反応速度も極めて緩やかです。効率と純度を高めるため、あらかじめ重曹を加熱して炭酸ナトリウムへ変えておきます。
工程: 200°Cのオーブンまたはフライパンで30分〜1時間加熱します。
化学変化: \(2NaHCO_3 \rightarrow Na_2CO_3 + H_2O + CO_2 \uparrow\)
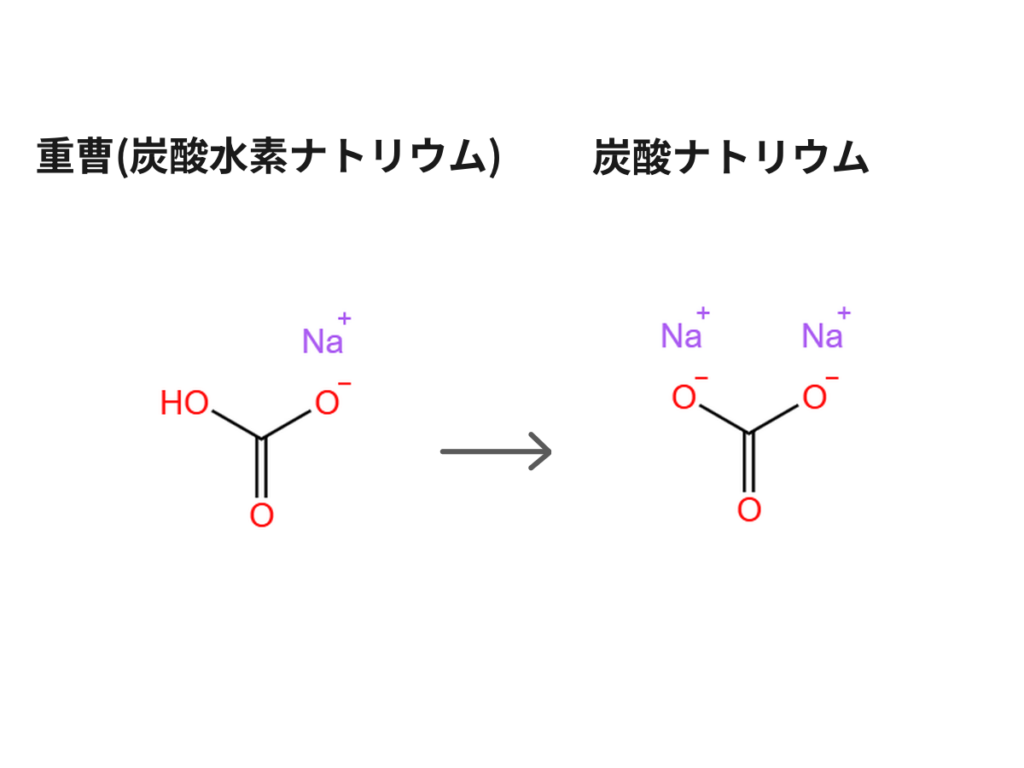
重曹の加熱なので、中学校とかで習う反応ですね。
(Sodium Bicarbonate (Baking Soda))
炭酸ナトリウムのモル質量は\(105.99 \, \text{g/mol} \)です。
なぜ焼くのか?
重曹(炭酸水素塩)よりも炭酸ナトリウム(炭酸塩)の方が塩基性が強く、酒石酸水素カリウムとの中和反応がスムーズに進行するためです。
2.反応式と目的物説明
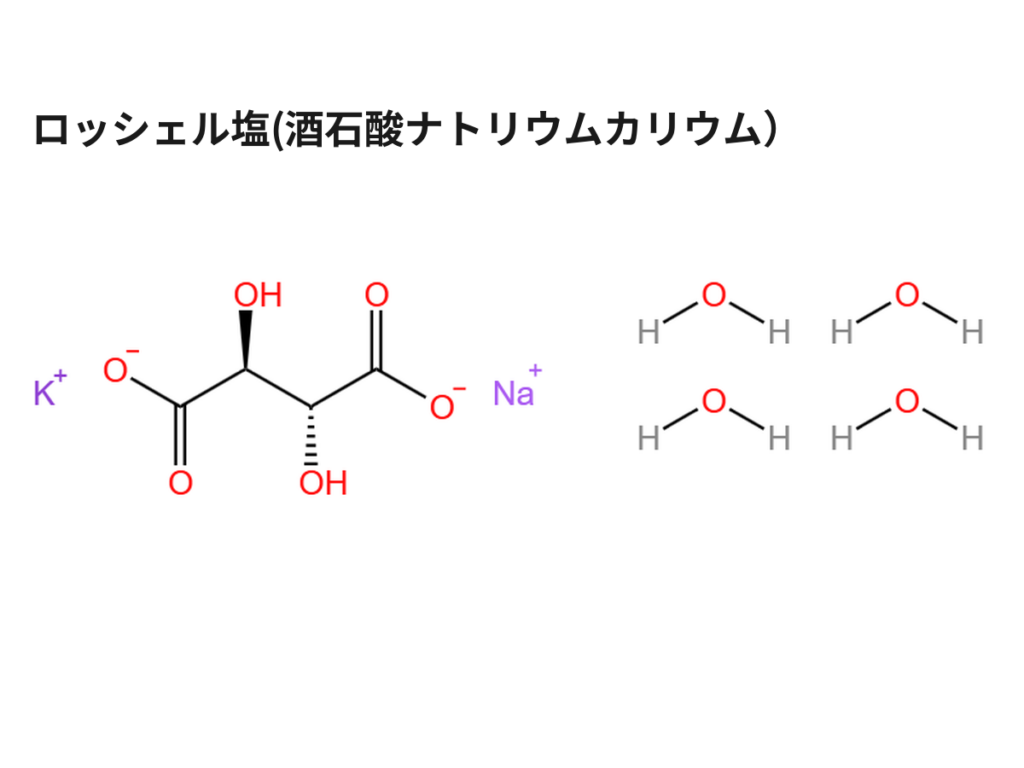
生成物(ロッシェル塩四水和物)
化学反応式:
\[2KHC_4H_4O_6 + Na_2CO_3 \rightarrow 2KNaC_4H_4O_6 \cdot 4H_2O + CO_2 \uparrow\] ・・・(1)
(※実際には水溶液中での反応なので、生成物は4水和物として析出します)
「2酒石酸カリウム+炭酸ナトリウム→ロッシェル塩4水和物と二酸化炭素の反応です。」
酒石酸カリウムと炭酸ナトリウムは、モル比で2対1で反応することがわかります。
3. 正確な配合比(重量比)
「過不足のない反応」を目指すため、モル質量から正確な比率を算出します。
A. 理論的な質量比(過不足なし)
先ほどの反応式(1)より、
モル質量:
- 酒石酸水素カリウム: \(188.18 \, \text{g/mol} \times 2 = 376.36 \, \text{g}\)
- 炭酸ナトリウム: \(105.99 \, \text{g/mol} \times 1 = 105.99 \, \text{g}\)
理論質量比(\(KHC_4H_4O_6 : Na_2CO_3\)): \(376.36 / 105.99 \approx \mathbf{3.551 : 1}\)
B. 200mlでのレシピ
今回は、未反応のアルカリ成分(炭酸ナトリウム)が残ると結晶の質に悪影響を及ぼすため、酒石酸水素カリウムをわずかに過剰(約5%)に加えることとしました。 酒石酸水素カリウムが反応せずに残っていたとしても。100度の水に対する溶解度が100倍も違うので、ロッシェル塩は完全に解けても酒石酸ナトリウムカリウムが解け残り、ろ過で分離できます。
計量値
- 精製水:\(200 \, \text{ml}\)
- 炭酸ナトリウム: \(28.2 \, \text{g}\)(これを基準に計算)
- 酒石酸水素カリウム: \(105.1 \, \text{g}\)
- ※理論量 \(100.1 \, \text{g}\) に対し、5%(約 \(5.0 \, \text{g}\))を過剰に加えた数値です。
この比率で得られる結果(理論値)
- 生成されるロッシェル塩: 約 \(150.1 \, \text{g}\)
- 20°Cでの溶解状態:
- 200mLの水に約 \(126.0 \, \text{g}\) が溶け込み、飽和母液となります。
- 残り約 \(24.1 \, \text{g}\) がロッシェル塩の結晶として析出します。
- 残存する不純物(酒石酸水素カリウム):
- 200mLの水に約 \(1.2 \, \text{g}\) だけが溶存し、残りの過剰分(約 \(3.8 \, \text{g}\) 以上)は濾過で除去されます。
精度のいい計量器が手元になかったので、過剰量で実験しようと思います。過剰量なので、理論上不純物が混じりますが、質量にして最大0.9%程で炭酸ナトリウムが解け残って分離できなくなるよりは良いと考えました。
B’. (Bの場合の処理) より純粋に取り出すための「二段階濾過」手順
Bの比率を用いた、純度を極限まで高めるためのプロセスです。
- 熱時濾過(不純物の一次排除):
- 100°C近くで全量を反応させた後、熱いうちに濾過します。
- ここで、過剰に入れた \(5.0 \, \text{g}\) のうち、溶けきれなかった大部分の未反応酒石酸水素カリウムを物理的に取り除きます。
- 冷却・静置(不純物の二次析出):
- 濾液を30°C程度までゆっくり冷やします。
- この過程で、温度降下に伴い溶解度が急減した「微量の酒石酸水素カリウム」が、ロッシェル塩よりも先に白い粉(スノー)として析出してきます。(30度で100ml当たりロッシェル塩は110g程度熔解し、原材料の酒石酸水素カリウムは0.9g熔解します。理論生成量は150gであるため30℃では、ロッシェル塩はほぼ完全に液中に溶けています。)
- 析出してきたスノーを一度濾過します。
- 冷時濾過(最終精製):
- 20°Cで再度濾過を行います。
- これにより、溶存していた不純物を熱力学的な下限値(\(1.2 \, \text{g} / 200 \, \text{ml}\))まで引き下げた、比較的純度の高い「ロッシェル塩飽和母液」が完成します。
この二段階目の濾過の後に析出したロッシェル塩(24g)程度が来ますが、このうち大きなものがあれば、たね結晶として利用します。
4. 反応の手順(失敗しないためのガイドと実験)
重曹の加熱から、3.Bの分量で実験をしてみました。
4.1 重曹の熱分解
炭酸ナトリウムで28.2gほしいので、ちょっと多めに重曹50gを加熱し炭酸ナトリウムにすることにしました。

重曹50g
完全に反応したら50gから31.54gになる計算です。(スケールの精度がgまでだったので、32g表記、適宜計量しながら加熱し、変化しなくったので、反応が終わったと判断しました。)

炭酸ナトリウム 32g
28g測り取っておきます

4.2 酒石酸水素カリウムの計量と反応容器の準備
酒石酸水素カリウムを計量します。こちらはどのみち濾過するので、そこまでシビアに測り取る必要はないため、大体105g気持ち多めで測り取ります。

酒石酸水素カリウムを計量(一度では多かったので分けて計量しています)
反応容器は、大き目のビーカーがよいのですが、手元になかったので、適当なガラス容器を用いて、フライパンの上で加熱することにしました。

加熱セットアップ
溶液を入れるためのガラス用と小さめのフライパンで加熱します。
4.3 加熱と反応
作業手順
- お湯を準備する: 水を80〜90°C程度を用意。
- 酒石酸水素カリウムを投入: お湯に酒石酸水素カリウムを入れます。この段階では完全には溶けず、白い濁った状態になります。
- 重曹を「少しずつ」加える: ここが最重要です。一度に全部入れると泡が爆発的に出て溢れます。
- ティースプーン1杯分くらいずつ加え、かき混ぜます。
- シュワシュワという泡立ちが完全に止まるまで、少しずつ重曹を足していきます。
- 透明度を確認: 反応が終わると、溶液は濁りが消えて透明に近い状態になります。

お湯に酒石酸水素カリウムを溶かす。
200mlに105gの酒石酸水素カリウムは完全に解け切らないので、ある程度解けるまでかき混ぜます。
白濁した溶液になり、若干量下に沈殿します。
微量の炭酸ナトリウムを加えて反応させる
反応初期だと、泡が多く立ち、泡も割れにくく吹きこぼれやすい(わきまけやすい)です。そのため、初めは本当に少量で試しながら、前の泡が消えてくるまで反応後、次を投入するようにしました。
反応がある程度進むと、泡がすぐ消えるようになるので、そのころには小さじくらいの量で投入しても問題ありませんでした。
酒石酸水素カリウムは、製菓用の酸味料に使われることがあるのですが、反応中作業場が薄くサイダー風のにおいに包まれました。酒石酸水素カリウムがもともと植物から生まれた(ワインの発酵過程でブドウなどから生成された)酸味料であることを実感できました。
4.4 熱時濾過と再結晶からのろ過
全量入れたのち、かき混ぜても炭酸が出なくなれば反応完了です。容器下部に沈殿が確認できます。これは、容量通り、酒石酸水素カリウムなので濾過します。(後で気づきましたが、結晶の析出を確認したいなどの理由がなければ、どのみち30℃でもう一度濾過するのでこの段階で濾過しなくてもよかったかもしれません。)

反応後の溶液下部の沈殿
こののち、30度になるまでゆっくり冷却していくと再度沈殿が現れます。反応後に残った酒石酸水素カリウムが析出してきたものなので、再度ろ過します。

底に薄く沈殿してくる。

温度を確認しながら待機
一度濾過し、20度まで待機し、再度ろ過すると母液の完成です。

完成したロッシェル塩の母液
若干黄色味がかった透明溶液になりました。
5.収率計算
計量してみると、最終的に得られた溶液の体積は268ml.質量は307gでした。
実測データ
- 溶液の体積: \(268 \, \text{ml}\)
- 溶液の質量: \(309 \, \text{g}\)
- 算出密度: \(\rho \approx 1.153 \, \text{g/ml}\)
収率の推定
ロッシェル塩水溶液の密度データに基づくと、密度 \(1.153 \, \text{g/ml}\) は重量パーセント濃度で約 26.5% (\(w/w\)) に相当します。ここから逆算すると、溶液内の物質量は以下の通りです。
- 溶質の総量(無水物換算): \(309 \, \text{g} \times 0.265 \approx \mathbf{81.9 \, \text{g}}\)
- 目的物(四水和物)の推定重量: \(81.9 \, \text{g} \times 1.343 \approx \mathbf{110.0 \, \text{g}}\)
収率(歩留まり)の評価
理論上の最大生成量(約 \(150.1 \, \text{g}\))に対し、今回の推定収率は 約 73% でした。
考察:
理論値との差(約 \(40 \, \text{g}\))は、主に以下の要因によるものと考えられます:
- 意図的に過剰投入した未反応原料の濾過による除去。
- 濾紙(コーヒーフィルタ)や容器への吸着・残留による物理的損失。
- 加熱・蒸発工程における組成の変化。
- 作業場の室温が7度だったことによる、液表面での結晶化での損失。
しかし、現在の \(268 \, \text{ml}\) という体積に対して \(110 \, \text{g}\) という溶質量は、\(20^{\circ}\text{C}\) 前後の室温で「飽和に近い、極めて扱いやすい濃度」であることを示しており、次回の結晶成長プロセスにとって理想的な母液が完成したと言えます。
考察:溶液の色について
溶液が黄金色を帯びているのは、おそらく、重曹の純度によるものだと思われます。掃除や台所で使うことを前提とした重曹を使ったため、これに微量ながら含まれる金属分がイオンになり着色したのだろうと考えられます。透明度が確保されていれば反応は完結しているため、結晶化の過程で、これらの着色成分は液側に残り、析出するロッシェル塩自体は無色透明な高純度体となるのが一般的です。
あと、もしかしたら、金属さじでの投入や作業が原因で、酒石酸が金属をキレートしたのかも?
6. まとめ
今回の合成でロッシェル塩の母液が手に入りました。次回は、種結晶の作成から、温度管理システムの作成をしていきたいと思います。
(次回予定地)